Adaptor TIANSeq cu un singur index (Illumina)
Caracteristici
■ Convenabil: SetA și SetB furnizează ambele 24 de indexuri unice, care pot fi selectate în mod liber în funcție de cerințe.
■ Ușor de utilizat: kitul este echipat cu tampon de diluare a adaptorului, care are o stabilitate puternică și poate fi utilizat direct pentru diluarea soluției de adaptor.
■ Controlul calității: controlul strict al calității și verificarea funcțională între loturi asigură acuratețea secvenței indexului.
Aplicații
1. Acest produs este utilizat pentru construirea de biblioteci de ADN și ARN pentru platforma de secvențiere de mare viteză Illumina în aplicarea secvențierii de nouă generație (NGS).
2. Aplicațiile specifice ale produsului includ secvențierea exonului întreg, secvențierea țintită, ARN-Seq, ChIP-Seq, secvențierea direcționată și secvențierea genomului întreg.
3. Trebuie remarcat faptul că acest produs nu este potrivit pentru secvențierea legată de metilare.
Informații despre secvența adaptorului
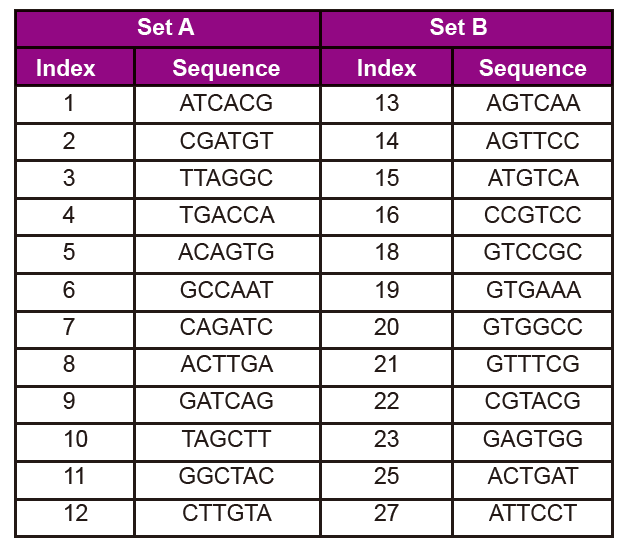
Secvența adaptorului include următoarele informații:
1. Secvență universală
5'-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCT
ACACGACGCTCTTCCGATCT-3 '
2. Indexul incluzând secvența
5'-GATCGGAAGAGCACACGTCTGAACTCCAGTCAC [index1-27] ATCTCGTATGCCGTCTTCTGCTTG-3 '
3. Număr index și secvență
Toate produsele pot fi personalizate pentru ODM / OEM. Pentru detalii,vă rugăm să faceți clic pe Serviciu personalizat (ODM / OEM)
În prezent, tehnologia de secvențiere cu randament ridicat se bazează în principal pe tehnologia de secvențiere de generație următoare. Deoarece lungimea de citire a tehnologiei de secvențiere a generației următoare este limitată, trebuie să împărțim secvența de lungime completă în biblioteci de fragmente mici pentru a le secvența. Conform nevoilor diferitelor experimente de secvențiere, de obicei alegem secvențierea cu un singur capăt sau secvențierea cu două capete. În prezent, fragmentele de ADN ale bibliotecii de secvențiere a generației următoare sunt distribuite în general în intervalul 200-800 bp.

a) ADN-ul este slab ca calitate și conține inhibitori. Utilizați probe de ADN de înaltă calitate pentru a evita inhibarea activității enzimei.
b) Cantitatea de probă de ADN este insuficientă atunci când se utilizează metoda fără PCR pentru a construi biblioteca de ADN. Când intrarea ADN-ului fragmentat depășește 50 ng, fluxul de lucru fără PCR poate fi efectuat selectiv în timpul procesului de construcție a bibliotecii. Dacă numărul de copii al bibliotecii este prea mic pentru a putea fi secvențiat direct, biblioteca ADN poate fi amplificată prin PCR după ligarea adaptorului.
c) Contaminarea cu ARN duce la cuantificarea inițială inexactă a ADN-ului Poate exista contaminare cu ARN în procesul de purificare a ADN-ului genomic, ceea ce poate duce la cuantificarea inexactă a ADN-ului și la încărcarea insuficientă a ADN-ului în timpul construcției bibliotecii. ARN-ul poate fi îndepărtat prin tratarea cu RNază.
A-1
a) Fragmentele mici (60 bp-120 bp) apar Fragmentele mici sunt de obicei fragmente de adaptor sau dimeri formați de adaptoare. Purificarea cu margele magnetice Agencourt AMPure XP poate elimina în mod eficient aceste fragmente de adaptor și poate asigura calitatea secvențierii.
b) Fragmente mari apar în bibliotecă după amplificarea PCR Dimensiunea fragmentului de ADN al bibliotecii va crește cu 120 bp după ce adaptorul este ligat. Dacă fragmentul ADN crește cu mai mult de 120 bp după ligarea adaptorului, acesta ar putea fi cauzat de amplificarea anormală a fragmentului de amplificare PCR excesivă. Reducerea numărului de cicluri de PCR poate preveni situația.
c) Dimensiunea anormală a fragmentelor de ADN din bibliotecă după ligarea adaptorului Lungimea adaptorului din acest kit este de 60 bp. Când cele două capete ale fragmentului sunt legate la adaptoare, lungimea va crește doar cu 120 bp. Când utilizați un alt adaptor decât cel furnizat de acest kit, vă rugăm să contactați furnizorul pentru a furniza informații relevante, cum ar fi lungimea adaptorului. Vă rugăm să vă asigurați că fluxul de lucru și funcționarea experimentului urmează pașii descriși în manual.
d) Dimensiunea anormală a fragmentului de ADN înainte de ligarea adaptorului. Motivul acestei probleme poate fi cauzat de condiții de reacție greșite în timpul fragmentării ADN-ului. Trebuie folosiți timpi de reacție diferiți pentru intrări diferite de ADN. Dacă intrarea ADN este mai mare de 10 ng, vă recomandăm să alegeți timpul de reacție de 12 min ca timp de pornire pentru optimizare, iar dimensiunea fragmentului produs în acest moment este în principal în intervalul 300-500 bp. Utilizatorii pot crește sau micșora lungimea fragmentelor de ADN timp de 2-4 minute în funcție de propriile cerințe pentru a optimiza fragmentele de ADN cu dimensiunea necesară.
A-2
a) Timpul de fragmentare nu este optimizat Dacă ADN-ul fragmentat este prea mic sau prea mare, vă rugăm să consultați Ghidul de selecție a timpului de fragmentare furnizat în instrucțiune pentru a determina timpul de reacție și utilizați acest punct de timp ca control, setați suplimentar un sistemul de reacție să prelungească sau să scurteze 3 minute pentru a face o ajustare mai precisă a timpului de fragmentare.
A-3
Distribuția anormală a dimensiunii ADN-ului după tratamentul de fragmentare
a) Metoda de dezghețare incorectă a reactivului de fragmentare sau reactivul nu este complet amestecat după decongelare. Decongelați reactivul de amestec enzimatic de 5 × fragment pe gheață. Odată dezghețat, amestecați reactivul uniform, aruncând ușor partea inferioară a tubului. Nu agitați reactivul!
b) Proba de intrare ADN conține EDTA sau alți poluanți Epuizarea ionilor de sare și a agenților de chelare în etapa de purificare a ADN este deosebit de importantă pentru succesul experimentului. Dacă ADN-ul este dizolvat în 1 × TE, utilizați metoda furnizată în instrucțiune pentru a efectua fragmentarea. Dacă concentrația EDTA în soluție este incertă, se recomandă purificarea ADN-ului și dizolvarea acestuia în apă deionizată pentru reacția ulterioară.
c) Cuantificarea inițială a ADN-ului incorectă Dimensiunea ADN-ului fragmentat este strâns legată de cantitatea de intrare ADN. Înainte de tratarea fragmentării, cuantificarea exactă a ADN-ului folosind Qubit, Picogreen și alte metode este esențială pentru a determina cantitatea exactă de ADN din sistemul de reacție.
d) Pregătirea sistemului de reacție nu respectă instrucțiunile Pregătirea sistemului de reacție fragmentat trebuie efectuată pe gheață strict conform instrucțiunilor. Pentru a asigura cel mai bun efect, toate componentele de reacție trebuie plasate pe gheață și pregătirea sistemului de reacție trebuie efectuată după răcirea completă. După finalizarea preparării, vă rugăm să pâlpâiți sau pipetați pentru a amesteca bine. Nu faceți vortex!
1. Metoda de amestecare necorespunzătoare (vortex, oscilație violentă etc.) va determina distribuția anormală a fragmentelor de bibliotecă (așa cum se arată în figura următoare), afectând astfel calitatea bibliotecii. Prin urmare, atunci când pregătiți soluția de reacție pentru fragmentarea amestecului, vă rugăm să pipetați ușor în sus și în jos pentru a amesteca sau utilizați vârful degetului pentru a bate și amesteca uniform. Aveți grijă să nu vă amestecați cu vortex.

2. Pentru construcția bibliotecii trebuie utilizat ADN de înaltă puritate
■ Bună integritate a ADN-ului: banda de electroforeză este mai mare de 30 kb, fără coadă
■ OD260 / 230:> 1,5
■ OD260 / 280: 1.7-1.9
3. Cantitatea de intrare ADN trebuie să fie exactă. Se sugerează utilizarea metodelor Qubit și PicoGreen pentru a cuantifica ADN, mai degrabă decât Nanodrop.
4. Conținutul de EDTA în soluția de ADN trebuie determinat EDTA are o mare influență asupra reacției de fragmentare. Dacă conținutul EDTA este ridicat, purificarea ADN trebuie efectuată înainte de testul ulterior.
5. Soluția de reacție de fragmentare trebuie preparată pe gheață. Procesul de fragmentare este sensibil la temperatura și timpul de reacție (în special după adăugarea unui amplificator). Pentru a asigura precizia timpului de reacție, vă rugăm să pregătiți sistemul de reacție pe gheață.
6. Timpul de reacție la fragmentare trebuie să fie precis Timpul de reacție al etapei de fragmentare va afecta direct dimensiunea produselor fragmentate, afectând astfel distribuția mărimii fragmentelor de ADN din bibliotecă.
1. Ce tip de probă se aplică acestui kit?
Tipul de probă aplicabil al acestui kit poate fi ARN total sau ARNm purificat cu o bună integritate a ARN-ului. Dacă se folosește ARN total pentru a construi biblioteca, se recomandă utilizarea kitului de epuizare a ARNr (Cat # 4992363/4992364/4992391) pentru a elimina mai întâi ARNr.
2. Pot fi folosite probe FFPE pentru a construi biblioteca cu acest kit?
ARNm din probele FFPE va fi degradat într-o anumită măsură, cu o integritate relativ slabă. Când utilizați acest kit pentru construcția bibliotecii, se recomandă optimizarea timpului de fragmentare (scurtarea timpului de fragmentare sau neefectuarea fragmentării).
3. Folosind pasul de selecție a mărimii furnizat în manualul produsului, ce ar putea determina segmentul inserat să apară o ușoară abatere?
Selectarea mărimii se va efectua în strictă conformitate cu etapa de selectare a mărimii din acest manual al produsului. Dacă există abateri, motivul ar putea fi că mărgelele magnetice nu sunt echilibrate la temperatura camerei sau nu sunt complet amestecate, pipeta nu este precisă sau lichidul rămâne în vârf. Se recomandă utilizarea sfaturilor cu adsorbție redusă pentru experiment.
4. Selectarea adaptoarelor în construcția bibliotecii
Kitul de construcție a bibliotecii nu conține reactiv adaptor și se recomandă utilizarea acestui kit împreună cu adaptorul TIANSeq cu un singur index (Illumina) (4992641/4992642/4992378).
5. QC al bibliotecii
Detectarea cantitativă a bibliotecii: Qubit și qPCR sunt utilizate pentru a determina concentrația de masă și respectiv concentrația molară a bibliotecii. Operațiunea este strict conformă cu manualul produsului. Concentrația bibliotecii va îndeplini în general cerințele secvențierii NGS. Detectarea gamei de distribuție a bibliotecii: Utilizarea Agilent 2100 Bioanalyzer pentru a detecta gama de distribuție a bibliotecii.
6. Selectarea numărului ciclului de amplificare
Conform instrucțiunilor, numărul de cicluri PCR este 6-12, iar numărul de cicluri PCR necesare ar trebui selectat în funcție de intrarea eșantionului. În bibliotecile cu randament ridicat, supraamplificarea are loc de obicei în grade diferite, care se manifestă printr-un vârf puțin mai mare după vârful intervalului țintă în detectarea Agilent 2100 Bioanalyzer sau concentrația detectată de Qubit este mai mică decât cea a qPCR. Amplificarea ușoară este un fenomen normal, care nu afectează secvențierea bibliotecii și analiza ulterioară a datelor.
7. Spikes apare în profilul de detectare al Agilent 2100 Bioanalyzer
Apariția vârfurilor în detectarea Agilent 2100 Bioanalyzer se datorează fragmentării inegale a probelor, unde vor exista mai multe fragmente de anumite dimensiuni, iar acest lucru va deveni mai evident după îmbogățirea PCR. În acest caz, se sugerează să nu se efectueze selecția mărimii, adică să se stabilească condiția de fragmentare la 94 ° C timp de 15 minute incubate, unde distribuția fragmentelor este mică și concentrată, iar omogenitatea poate fi îmbunătățită.
Categorii de produse
DE CE NE ALEGE
De la înființare, fabrica noastră dezvoltă produse de primă clasă mondială, respectând principiul
de calitate mai întâi. Produsele noastre au câștigat o reputație excelentă în industrie și o valoare de încredere în rândul clienților noi și vechi ..








