2 × Taq PCR Mix
Definirea activității
Activitatea 1 unitate (U) Taq ADN polimerază este definită ca cantitatea de enzimă necesară pentru a încorpora 10 nmol deoxinucleotide în substanțe insolubile în acid la 74 ℃ în 30 de minute folosind ADN de spermă de somon activat ca șablon / primer.
Control de calitate
Puritatea prin detectarea SDS-PAGE este mai mare de 99%; Nu este detectată nicio activitate de nuclează exogenă; Gena cu o singură copie din genomul uman ar putea fi amplificată eficient; Nicio modificare semnificativă a activității atunci când este păstrată la temperatura camerei timp de o săptămână.
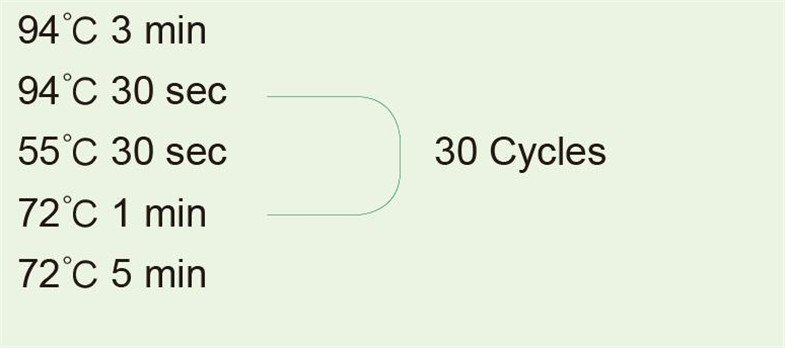
Parametrii tehnici principali
Enzima are activitate de polimerază 5'-3 'și activitate de exonuclează 5'-3' și fără activitate de exonuclează 3'-5 '. Viteza de extensie a polimerizării ADN este de 1-2 kb / min la 70-75 ℃. Produsul PCR are 3'-dA surplombe, care pot fi clonate direct în vectorul de clonare TA.
Aplicații
Este, în general, utilizat pentru amplificare, extinderea primerului, secvențierea și coada A la capătul contondent al ADN-ului care este <6 kb și are cerințe de fidelitate redusă.
Toate produsele pot fi personalizate pentru ODM / OEM. Pentru detalii,vă rugăm să faceți clic pe Serviciu personalizat (ODM / OEM)
 |
Utilizarea ADN-ului genomic uman ca șablon pentru a amplifica fragmentul de 1 kb |
 |
După reacția PCR, luați 5 μl pentru detectarea electroforezei. |
Șablon A-1
■ Șablonul conține impurități proteice sau inhibitori Taq etc. —— Purificați șablonul ADN, eliminați impuritățile proteice sau extrageți ADN șablon cu kituri de purificare.
■ Denaturarea șablonului nu este completă - Creșteți corespunzător temperatura de denaturare și prelungiți timpul de denaturare.
■ Degradarea șablonului - Pregătiți din nou șablonul.
A-2 Grund
■ Calitatea slabă a primerilor —— Re-sintetizați primerul.
■ Degradarea primerului ——Aliquot primerii cu concentrație mare în volum mic pentru conservare. Evitați înghețarea și dezghețarea multiplă sau crioconservarea pe termen lung de 4 ° C.
■ Proiectarea necorespunzătoare a grundurilor (de exemplu, lungimea grundului nu este suficientă, dimerul format între grunduri etc.) -Grunduri de reproiectare (evita formarea dimerului grundului și a structurii secundare)
A-3 Mg2+concentraţie
■ Mg2+ concentrația este prea mică ——Măriți în mod corespunzător Mg2+ concentrație: Optimizați Mg2+ concentrație printr-o serie de reacții de la 1 mM la 3 mM cu un interval de 0,5 mM pentru a determina Mg optim2+ concentrația pentru fiecare șablon și grund.
A-4 Temperatura de recoacere
■ Temperatura ridicată de recoacere afectează legarea grundului și șablonului. —— Reduceți temperatura de recoacere și optimizați starea cu un gradient de 2 ° C.
A-5 Timp de prelungire
■ Timp scurt de prelungire —— Măriți timpul de prelungire.
Fenomene: eșantioanele negative arată, de asemenea, benzile secvenței țintă.
A-1 Contaminarea PCR
■ Contaminarea încrucișată a secvenței țintă sau a produselor de amplificare —— Nu pipetați cu atenție proba care conține secvența țintă în eșantionul negativ sau vărsați-le din tubul centrifugii. Reactivii sau echipamentele ar trebui să fie autoclavizate pentru a elimina acizii nucleici existenți, iar existența contaminării ar trebui determinată prin experimente de control negativ.
■ Contaminarea reactivului ——Alocați reactivii și depozitați la temperatură scăzută.
A-2 Primer
■ Mg2+ concentrația este prea mică ——Măriți în mod corespunzător Mg2+ concentrație: Optimizați Mg2+ concentrație printr-o serie de reacții de la 1 mM la 3 mM cu un interval de 0,5 mM pentru a determina Mg optim2+ concentrația pentru fiecare șablon și grund.
■ Proiectarea necorespunzătoare a primerului, iar secvența țintă are omologie cu secvența non-țintă. —— Grunduri de reproiectare.
Fenomene: benzile de amplificare PCR sunt incompatibile cu dimensiunea așteptată, fie mare, fie mică, sau uneori apar ambele benzi de amplificare specifice și benzi de amplificare nespecifice.
A-1 Primer
■ Specificitate slabă a primerului
—— Grund pentru reproiectare.
■ Concentrația grundului este prea mare ——Măriți în mod corespunzător temperatura de denaturare și prelungiți timpul de denaturare.
A-2 Mg2+ concentraţie
■ Mg2+ concentrația este prea mare —— Reduceți în mod corespunzător concentrația de Mg2 +: Optimizați Mg2+ concentrație printr-o serie de reacții de la 1 mM la 3 mM cu un interval de 0,5 mM pentru a determina Mg optim2+ concentrația pentru fiecare șablon și grund.
A-3 Polimerază termostabilă
■ Cantitate excesivă de enzime —— Reduceți cantitatea enzimatică în mod adecvat la intervale de 0,5 U.
A-4 Temperatura de recoacere
■ Temperatura de recoacere este prea scăzută ——Măriți corespunzător temperatura de recoacere sau adoptați metoda de recoacere în două etape
A-5 cicluri PCR
■ Prea multe cicluri PCR —— Reduceți numărul de cicluri PCR.
A-1 Primer—— Specificitate slabă —— Re-proiectați grundul, schimbați poziția și lungimea grundului pentru a spori specificitatea acestuia; sau efectuați PCR imbricat.
A-2 Șablon ADN
—— Șablonul nu este pur —— Purificați șablonul sau extrageți ADN cu kituri de purificare.
A-3 Mg2+ concentraţie
——Mg2+ concentrația este prea mare —— Reduceți în mod corespunzător Mg2+ concentrație: Optimizați Mg2+ concentrație printr-o serie de reacții de la 1 mM la 3 mM cu un interval de 0,5 mM pentru a determina Mg optim2+ concentrația pentru fiecare șablon și grund.
A-4 dNTP
——Concentrația de dNTP este prea mare —— Reduceți în mod corespunzător concentrația de dNTP
A-5 Temperatura de recoacere
——Temperatura prea scăzută de recoacere ——Măriți corespunzător temperatura de recoacere
A-6 Cicluri
——Prea multe cicluri ——Optimizați numărul ciclului

Primul pas este alegerea polimerazei adecvate. Polimeraza Taq regulată nu poate fi corectată din cauza lipsei activității de exonuclează 3'-5 'și nepotrivirea va reduce considerabil eficiența extensiei fragmentelor. Prin urmare, polimeraza Taq obișnuită nu poate amplifica în mod eficient fragmente țintă mai mari de 5 kb. Taq polimeraza cu modificări speciale sau altă polimerază de înaltă fidelitate ar trebui selectată pentru a îmbunătăți eficiența extensiei și pentru a satisface nevoile de amplificare a fragmentelor lungi. În plus, amplificarea fragmentelor lungi necesită, de asemenea, ajustarea corespunzătoare a designului primerului, timpul de denaturare, timpul de extindere, pH-ul tampon etc. De obicei, primerii cu 18-24 bp pot duce la un randament mai bun. Pentru a preveni deteriorarea șablonului, timpul de denaturare la 94 ° C ar trebui redus la 30 sec sau mai puțin pe ciclu, iar timpul de creștere a temperaturii la 94 ° C înainte de amplificare ar trebui să fie mai mic de 1 min. Mai mult, setarea temperaturii de extindere la aproximativ 68 ° C și proiectarea timpului de extindere în funcție de rata de 1 kb / min poate asigura o amplificare eficientă a fragmentelor lungi.
Rata de eroare a amplificării PCR poate fi redusă utilizând diverse ADN polimeraze cu fidelitate ridicată. Dintre toate ADN polimerazele Taq găsite până acum, enzima Pfu are cea mai mică rată de eroare și cea mai mare fidelitate (vezi tabelul atașat). În plus față de selecția enzimei, cercetătorii pot reduce în continuare rata de mutație a PCR prin optimizarea condițiilor de reacție, inclusiv optimizarea compoziției tampon, concentrația polimerazei termostabile și optimizarea numărului ciclului PCR.
Categorii de produse
DE CE NE ALEGE
De la înființare, fabrica noastră dezvoltă produse de primă clasă mondială, respectând principiul
de calitate mai întâi. Produsele noastre au câștigat o reputație excelentă în industrie și o valoare de încredere în rândul clienților noi și vechi ..








